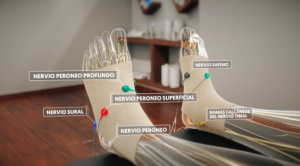
La neuromodulación periférica se perfila como una de las estrategias más prometedoras en medicina moderna. Su fundamento es la aplicación de estímulos eléctricos sobre nervios periféricos para modular la actividad del sistema nervioso. Los beneficios potenciales abarcan desde el manejo del dolor crónico hasta la modulación inflamatoria y la rehabilitación neurológica. Sin embargo, surge la pregunta: ¿qué dice la evidencia científica actual?

¿Cómo funciona la neuromodulación periférica?
Los nervios periféricos conectan el cuerpo con el cerebro. En presencia de lesión o enfermedad crónica, estos circuitos pueden estar desregulados, volviéndose hiperactivos y generando dolor persistente, inflamación o disfunción.
La neuromodulación periférica actúa como regulador de esa actividad. Algunos mecanismos propuestos en la literatura incluyen:
- Activación de fibras sensoriales Aβ no dolorosas, que pueden competir con señales nociceptivas y reducir su transmisión.
- Modulación del sistema inmune, con disminución de citocinas proinflamatorias en algunas condiciones modelo.
- Equilibrio autonómico, mejorando la comunicación entre los sistemas simpático y parasimpático.
- Estimulación de plasticidad neural, favoreciendo la reorganización de conexiones en el sistema nervioso tras lesión o estímulo crónico.
Evidencia científica: ¿dónde ya tenemos resultados?
A continuación, se resumen algunos de los campos en los que la neuromodulación periférica ya ha mostrado resultados clínicos relevantes:
- Dolor neuropático: en neuralgia posherpética y dolor neuropático en general, la estimulación nerviosa periférica ha mostrado efectos analgésicos significativos en múltiples ensayos clínicos y revisiones sistemáticas recientes.
- Dolor lumbar crónico: las revisiones clínicas recomiendan la neuromodulación periférica como una opción adyuvante en pacientes con lumbalgia crónica refractaria, aunque los diseños de los estudios siguen siendo heterogéneos.
- Dolor posoperatorio y síndrome de miembro fantasma: ensayos aleatorizados muestran que la estimulación nerviosa percutánea aplicada durante las semanas posteriores a una amputación o cirugía puede reducir el dolor fantasma y mejorar la movilidad en determinados pacientes.
- Enfermedades inflamatorias crónicas: la estimulación vagal (en modalidades invasivas o no invasivas) activa el eje colinérgico antiinflamatorio, reduciendo marcadores como TNF-α e IL-6 en estudios experimentales y clínicos sobre artritis reumatoide y enfermedad de Crohn.
El papel del nervio vago: más allá de la periferia
Aunque pertenece al sistema nervioso periférico, el nervio vago conecta directamente los órganos, el sistema inmunitario y el cerebro.
Su estimulación se considera un puente entre la neuromodulación local y la sistémica, con un impacto global en el organismo.
Los dispositivos de estimulación vagal no invasiva (nVNS) ya cuentan con aprobación para el tratamiento de la migraña y la cefalea en racimos, lo que pone de manifiesto el potencial terapéutico de este eje.
¿Dónde encaja NESA® en este escenario?
Desde un punto de vista conceptual, existen dos grandes enfoques en neuromodulación periférica:
- Intervención local, dirigida a nervios específicos para el tratamiento de afecciones localizadas (como el dolor crónico o el dolor posoperatorio).
- Intervención sistémica, orientada a modular redes autonómicas e inflamatorias, con impacto en funciones como el sueño, el equilibrio emocional y la recuperación global.
La tecnología NESA® XSIGNAL se sitúa en este segundo enfoque. A través de una estimulación eléctrica suave, no invasiva, y aplicada en puntos distales del cuerpo, busca modular de forma global el sistema nervioso autónomo.
Entre sus posibles efectos se incluyen:
- Contribuir al restablecimiento del equilibrio simpático–parasimpático.
- Atenuar la hiperactividad inflamatoria asociada al dolor crónico y la fatiga.
- Favorecer la recuperación neurológica y funcional, de acuerdo con los datos clínicos actualmente disponibles.
De este modo, NESA® representa la aplicación clínica de los avances más recientes en neuromodulación periférica, ofreciendo un enfoque innovador para la regulación autonómica y la recuperación funcional, con un perfil de seguridad bien documentado y una base de evidencia científica en constante crecimiento.

NESA®: Perspectivas actuales y líneas futuras
La medicina y la fisioterapia avanzan hacia tratamientos personalizados, con dispositivos menos invasivos y protocolos adaptados a cada paciente.
El objetivo principal es contribuir al abordaje de enfermedades complejas mediante soluciones basadas en evidencia, seguridad y rigor científico.
Referencias
Bonaz, B., Sinniger, V., Pellissier, S., & Picq, C. (2021). Vagus nerve stimulation at the interface of brain–gut interactions in inflammatory bowel disease and rheumatoid arthritis. Nature Reviews Gastroenterology & Hepatology, 18(3), 161–177. https://doi.org/10.1038/s41575-020-00388-7
Dawson, J., Liu, C. Y., Francisco, G. E., Cramer, S. C., Wolf, S. L., Dixit, A., … & Durand, D. M. (2021). Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. The Lancet, 397(10284), 1545–1553. https://doi.org/10.1016/S0140-6736(21)00475-X
Deer, T. R., et al. (2022). Evidence-based consensus guidelines for peripheral nerve stimulation. Pain Physician, 25(3), E305–E324.
Deer, T. R., Pope, J. E., Lamer, T. J., Provenzano, D. A., FitzGerald, J. J., Hunter, C. W., & Mekhail, N. (2024). Peripheral nerve stimulation for the treatment of chronic neuropathic pain: Current perspectives and future directions. Pain and Therapy, 13(2), 351–367. https://doi.org/10.1007/s40122-024-00659-6
Gilmore, C. A., Deer, T. R., Desai, M. J., et al. (2025). Four-year follow-up from a prospective, multicentre study of percutaneous 60-day peripheral nerve stimulation for chronic low back pain. Pain and Therapy, 14, 1103–1115. https://doi.org/10.1007/s40122-025-00737-3
Gilmore, C. A., Kapural, L., McGee, M. J., Boggs, J. W., & Rosen, A. (2022). Peripheral nerve stimulation for chronic low back pain: A prospective multicentre trial. Pain Medicine, 23(7), 1223–1234. https://doi.org/10.1093/pm/pnab329
Goadsby, P. J., Grosberg, B. M., Mauskop, A., Cady, R., & Simmons, K. A. (2014). Non-invasive vagus nerve stimulation for acute treatment of cluster headache: The PREVA study. Cephalalgia, 34(12), 986–999. https://doi.org/10.1177/0333102414557899
Koopman, F. A., Chavan, S. S., Miljko, S., Grazio, S., Sokolović, S., Schuurman, P. R., Mehta, A. D., Levine, Y. A., Faltys, M., Zitnik, R., Tracey, K. J., & Tak, P. P. (2016). Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. Proceedings of the National Academy of Sciences, 113(29), 8284–8289. https://doi.org/10.1073/pnas.1605635113
Rao, R., Zhou, Y., D’Souza, R. S., & Bendel, M. A. (2021). Percutaneous peripheral nerve stimulation for postoperative and phantom limb pain: A systematic review. Pain Reports, 6(6), e972. https://doi.org/10.1097/PR9.0000000000000972
Rauck, R. L., et al. (2021). Percutaneous peripheral nerve stimulation for the treatment of post-amputation pain. Pain Medicine, 22(3), 548–560. https://doi.org/10.1093/pm/pnaa430
Sio, L. C. O., Hom, B., Garg, S., & Abd-Elsayed, A. (2023). Mechanism of action of peripheral nerve stimulation for chronic pain: A narrative review. International Journal of Molecular Sciences, 24(5), 4540. https://doi.org/10.3390/ijms24054540